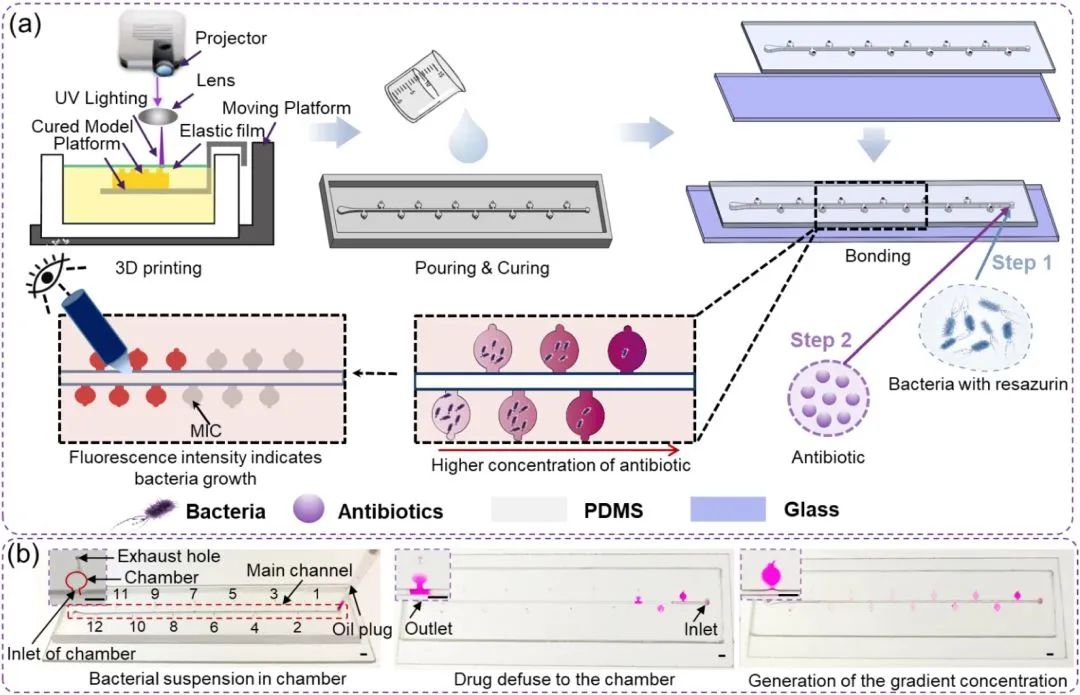
中南大学陈泽宇教授课题组《COLLOID SURFACE B》:用于原位形成纯化脂质体的透析功能化微流控平台
发布日期:2024-09-18
浏览量:357次
脂质体作为一种多功能药物载体,能够靶向递送多种治疗药物至特定部位,已广泛应用于癌症治疗和生物医学成像等领域。近年来,连续流微流控技术被视为一种前景广阔的脂质体制备方法。该技术通过在微流控装置中将含有脂质的有机相(如乙醇)与水相混合,促使脂质分子自组装形成脂质体。相比传统的宏观方法,微流控技术显著提升了脂质体的尺寸均匀性和包封效率(EE)。尽管微流控技术在脂质体制备中优势显著,如何使用微流控技术在原位实现脂质体纯化仍是一个挑战。特别是在微流控装置集成过程中,去除游离药物和有机溶剂(如乙醇)的纯化过程存在技术难题,这限制了脂质体生产的效率。
目前,已有多种策略用于载药脂质体的纯化,包括透析、凝胶色谱和超滤等方法。然而,这些传统纯化技术通常存在步骤繁琐、耗时长的局限性。在微流控技术介导的脂质体生产过程中,脂质体与乙醇长时间共存可能导致纳米载体的不稳定性及包封物质的泄漏。微流控透析技术通过快速去除游离药物和乙醇,为解决这些问题提供了潜在的解决方案。
近期,中南大学陈泽宇教授课题组在《Colloids and Surfaces B: Biointerfaces》期刊上在线发表题为“Dialysis-functionalized microfluidic platform for in situ formation of purified liposomes”的原创性论著。该研究发明了一种透析功能化微流控平台(dialysis-functionalized microfluidic platform DFMP),该平台有助于在脂质体制备的同时进行透析这一纯化过程。与传统透析方法相比,DFMP制备的脂质体显示出更高的EE和更窄的尺寸分布。此外,体内光声(PA)成像验证了制备的脂质体的优异性能。结果表明,DFMP可以作为提高载药脂质体的生产效率和载药性能的有效工具。

首先,作者提出了一种新型透析功能化微流控平台,用于脂质体的制备与纯化。在设计上,作者利用三维螺旋微混合流道,并通过摩方精密面投影微立体光刻(PμSL)高精度3D打印技术(nanoArch® S140,精度:10μm)制作了微流控混合芯片和透析芯片。随后,将透析膜以夹持方式集成到芯片内部,形成具备透析功能的微流控平台。该平台能够在合成脂质体的同时,对其进行透析处理,从而实现脂质体的原位纯化。
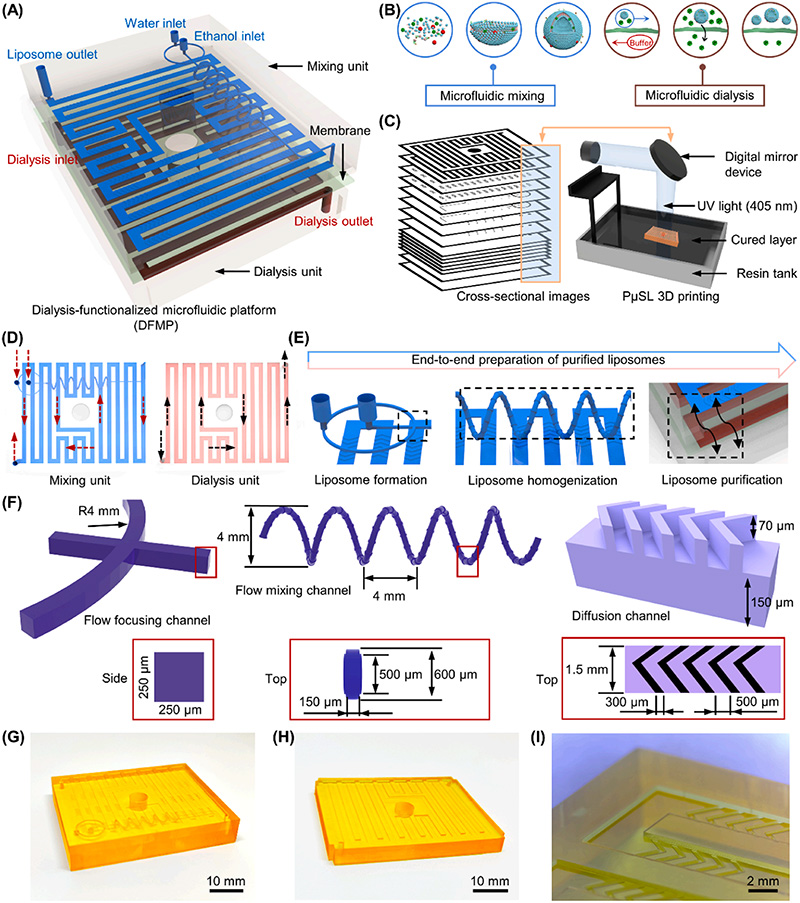
图1. 透析功能化微流控平台(DFMP)的设计、制造方案。
作者对透析功能化微流控平台的透析效率进行了评估。结果显示,随着透析液流速与样品溶液流速比值的增加,透析效率逐步提升。当比值达到900:1时,亚甲基蓝(MB)和吲哚菁绿(ICG)溶液的透析效率分别达到了93.48±0.44%和84.71±0.80%的最高值,成功去除了脂质体溶液中大部分的游离药物和杂质。
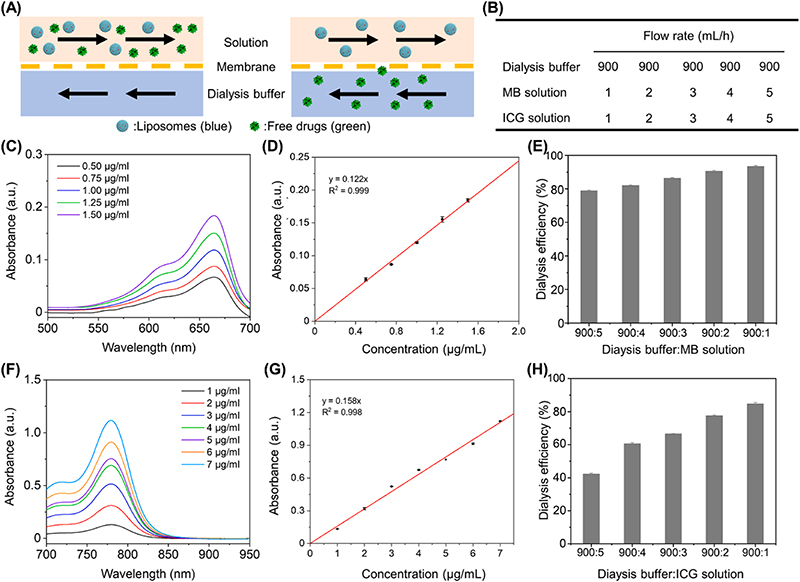
图2. 透析功能化微流控平台透析效率测试。
然后,作者使用透析功能化微流控平台合成了两种载药脂质体,结果显示,相较于传统透析,使用透析功能化微流控平台可以在相同的流率比下合成粒径更小、包封率更高、尺寸更加均一的脂质体。
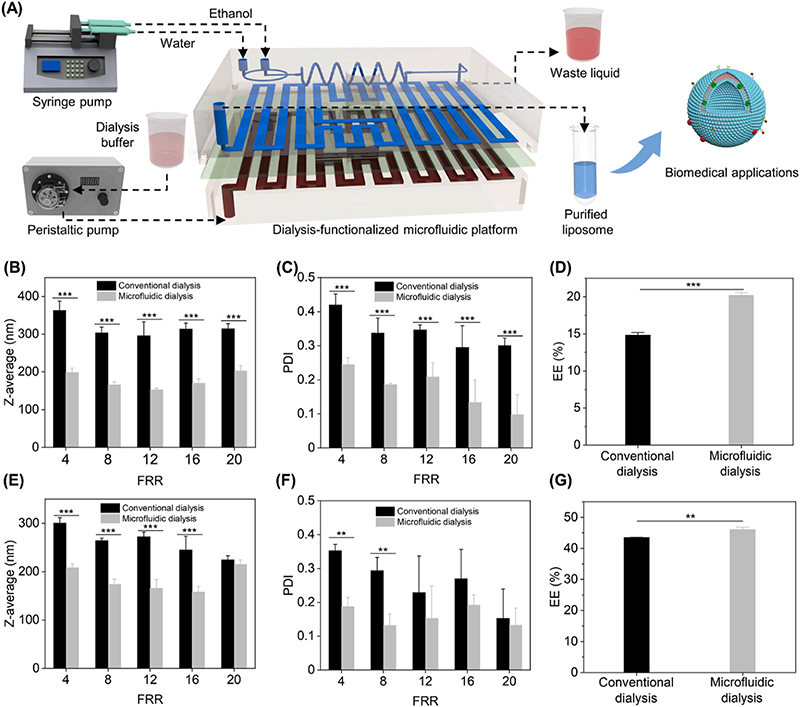
图3. 不同纯化方式下的脂质体粒径、PDI和包封率测试。
作者进一步对比了常规透析和微流控透析合成的载药脂质体在小动物光声成像中的表现。结果显示,两种纯化方式合成的脂质体在体内分布上存在显著差异。使用微流控透析纯化的载有吲哚菁绿(ICG)的脂质体表现出更强的肿瘤渗透性和滞留能力,表明了其在肿瘤靶向药物递送中的潜在优势。
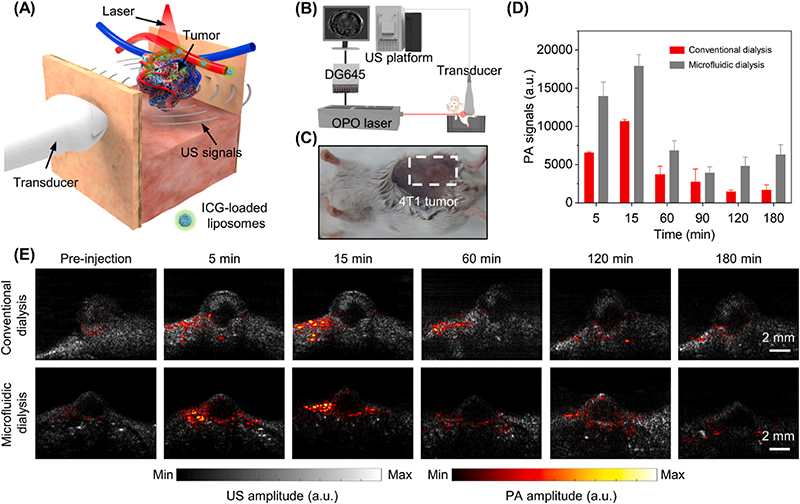
图4. 使用不同纯化方式的脂质体在小鼠体内PA成像实验。
与其他用于脂质体合成的微流控混合芯片相比,本研究提出的透析功能化微流控平台具有显著优势:它能够在脂质体制备的同时实现纯化过程。此外,该平台能够快速制备高包封率、粒径分布均匀的脂质体,符合生物医药领域对脂质体药物便捷制备的要求,并为脂质体药物的工业化生产提供了重要的技术指导。
原文链接:https://doi.org/10.1016/j.colsurfb.2024.113829