基于微流循环肿瘤细胞无标记声学分离的肿瘤术后评估
发布日期:2022-04-07
浏览量:1732次
以下文章来源于智能仿生与微纳系统 ,作者冯林实验室
大约90%的肿瘤相关死亡可归因于转移瘤的复发。然而,在经过手术切除等初期治疗后,直接进行化疗,往往会造成过度治疗,加速病发。因此,长期监测CTC动态变化并据此调整治疗策略,可防止过度治疗并且可以及时阻止肿瘤转移和复发。因此,CTC检测已成为一种新的诊断和预后的生物标志物,可为癌症治疗提供有价值的指导。
物理场与微流控的复合装置可以大大提高单纯依靠芯片微纳结构对CTC进行的筛选。然而,基于这些方法获得的CTC数据与患者预后转移的形成很难被证实。近日,北京航空航天大学机械工程学院仿生与微纳研究所冯林副教授课题组利用声波微流控从手术切除乳腺肿瘤小鼠全血中捕获CTCs,建立一种简单、快速、低成本的术后评价体系,并成功预测了肿瘤转移。
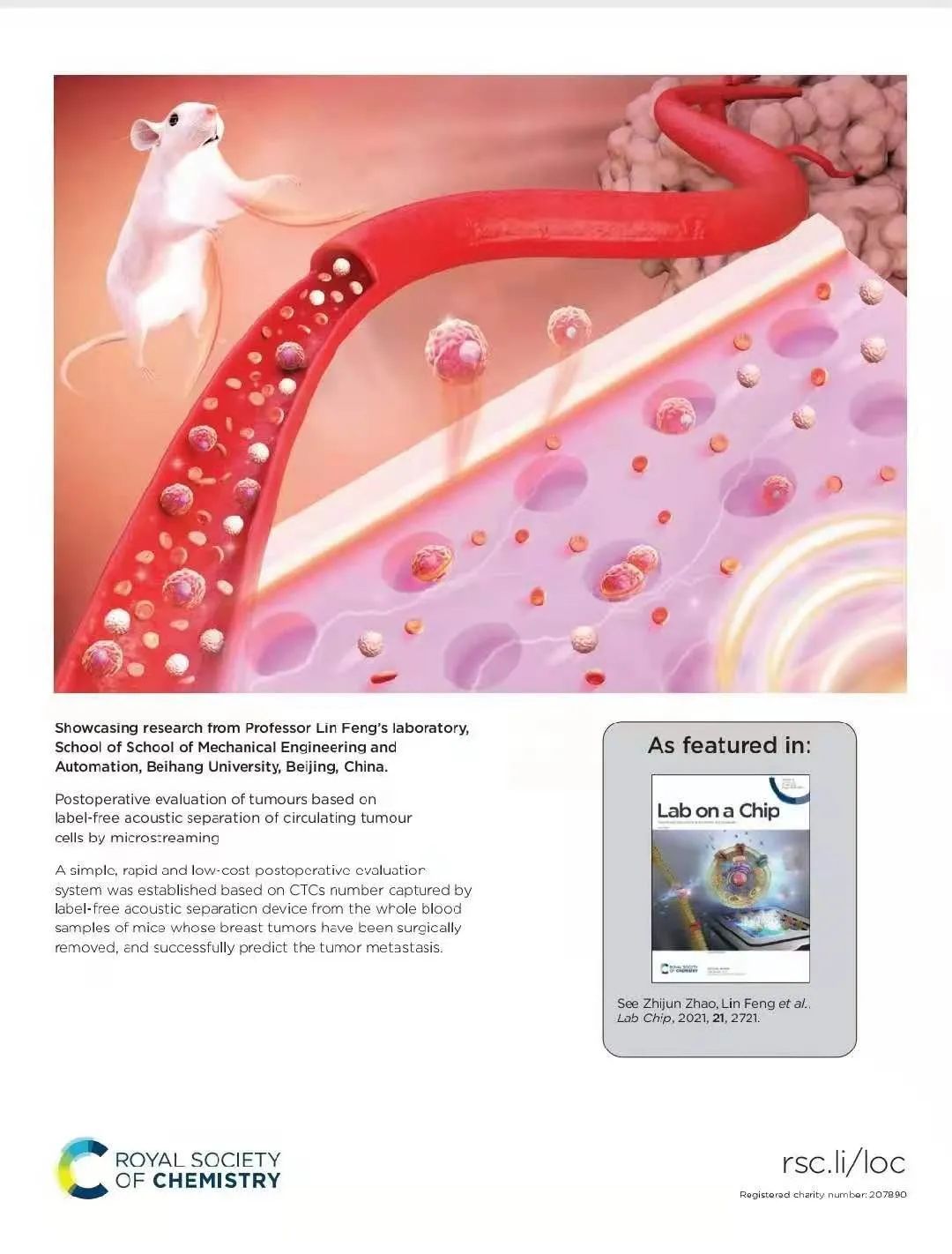
图一 通过声微流捕获循环肿瘤细胞来预测肿瘤转移
首先,研究团队采用面投影微立体光刻3D打印技术(nanoArch S140,摩方精密)设计制造了一种微流控芯片,芯片底部分布着直径为100μm,高度为80μm的微孔阵列。该芯片封装在厚度为10μm的玻璃片上,通过信号发生器和放大器将信号通过压电陶瓷片传递给微流控,超声信号和微流控通道中的液体在微孔处形成声微流。利用该声流可以对不同粒径的聚苯乙烯小球,肿瘤细胞,卵母细胞和绿眼虫进行捕获,旋转,搬运等多种操作。其次,利用浓度已知的肿瘤细胞对该微流控装置的捕获效率进行评价,实验结果显示,该装置的捕获效率可达96%。再次,对手术切除肿瘤后的小鼠血液进行筛选,并根据CTC数量做出小鼠形成转移的可能性。最后,经过长期观察术后小鼠的转移灶形成情况,验证预测结果。肿瘤转移情况与根据声微流捕获的CTC数量做出的预测一致。
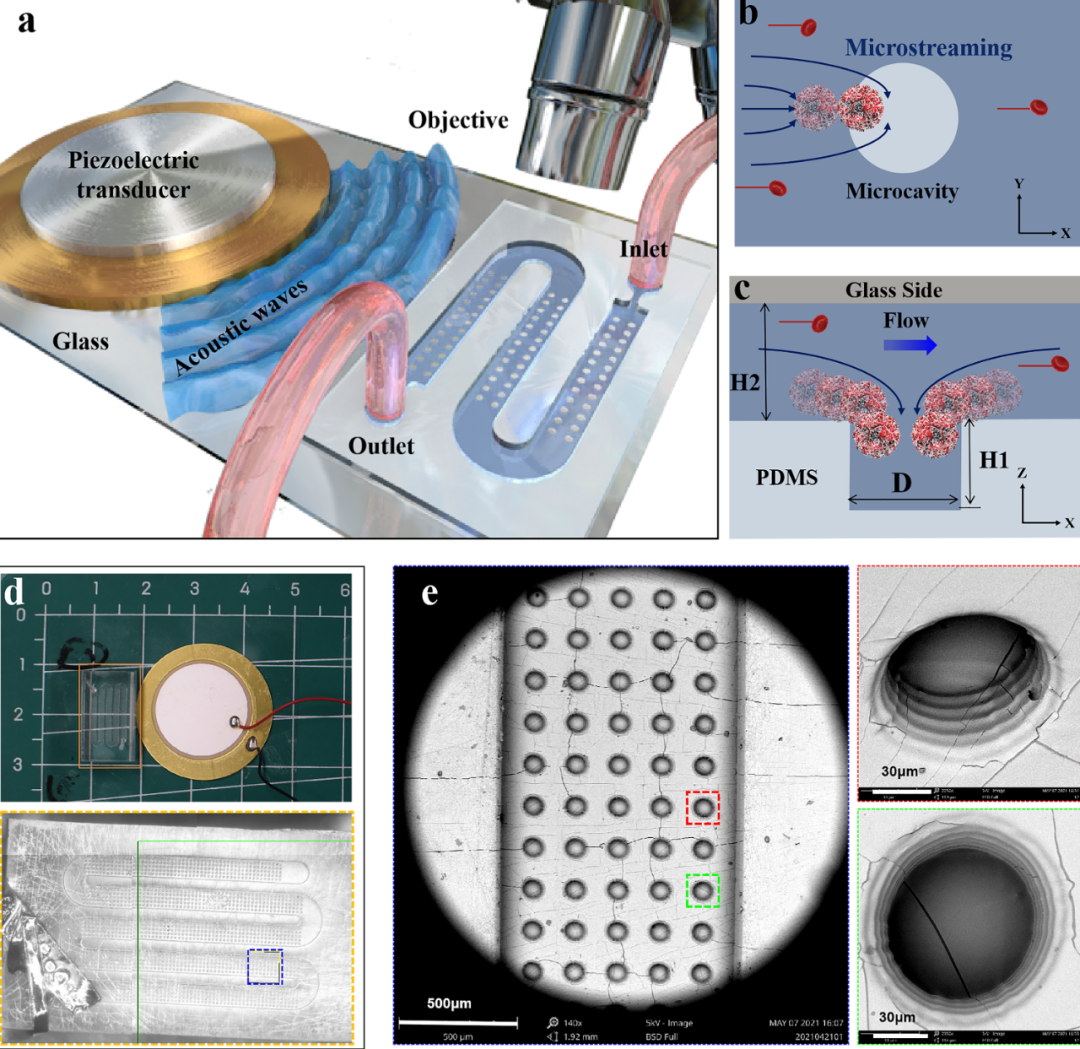
图二 基于振荡底微腔阵列的细胞分离声射流装置原理及实物图
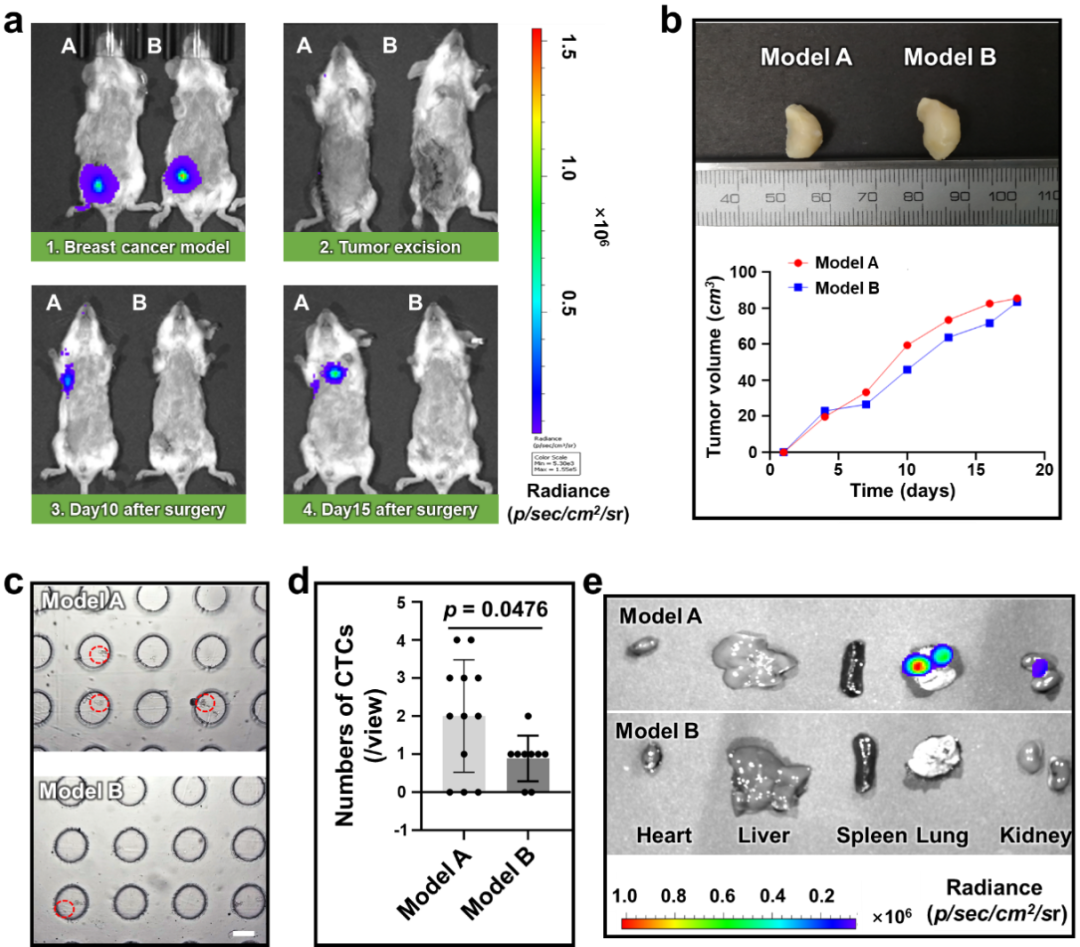
图三 基于CTC声流控装置捕获乳腺癌进行肺转移能力的评估
该项研究成果获得国家重点研发计划(No.2019YFB1309700)及北京新星科技计划项目(No. Z191100001119003)支持,以“Postoperative evaluation of tumorbased on label-free acoustic separation of circulating tumor cells bymicrostreaming ”为题发表于国际期刊《Lab on a chip》(北京航空航天大学白雪博士,宋斌硕士为共同第一作者)。